Velocidad de reacción de cinc con ácido sulfúrico.
Se va a estudiar la velocidad de la reacción en que una disolución de ácido sulfúrico ataca a cinc en polvo para
producir hidrógeno, cuyo volumen se mide en función del tiempo.
Las mediciones se realizan para varias concentraciones de ácido y para varias temperaturas.
Enlace al guión de laboratorio.




Material
- Ácido sulfúrico 5M |
.
|
Comentarios a la preparación del montaje
Las disoluciones de ácido sulfúrico de concentración 2,5M y 1,25M se preparan por dilución a la mitad de la disolución 2M.
La parte del tubo acodado que se introduce en la bureta no puede medir más de dos o tres centímetros para poderlo introducir sin
que entre aire en la bureta.
En cualquier caso, es inevitable que entre aire al alimentar el ácido y ocupar volumen en el matraz.
Por tanto, a la medición de la probeta hay que restarle el volumen inicial y contar volumen y tiempo sólo cuando empieza el burbujeo
por la producción de gas en la reacción.
El burbujeo no es constante, ya que el tubo acodado se va llenando de gas hasta que este escapa. Por ello es preferible tomar tiempos
tras un burbujeo y luego leer el nivel, que no varía durante varios segundos.
Aspectos didácticos
Este trabajo pretende:
- Preparar disoluciones de varias concentraciones molares por dilución.
- Medir la dependencia de la concentración una cinética química.
- Recoger el gas producido por una reacción en una bureta de gases.
- Utilizar las gráficas volumen de gas-tiempo para inferir el comportamiento de la cinética con la concentración y
con la temperatura.
La preparación de la disolución 5M del ácido sulfúrico puede ser una práctica en si misma, pero tiene el problema de trabajar
con algo tan corrosivo como el sulfúrico puro. Es preferible tener preparada la disolución 5M y que preparen las demás por dilución.
La reacción es bastante lenta y no necesita atención constante. Se puede hacer otro trabajo como algún cálculo de química
e interrumpirlo cada 5 o 10 minutos para tomar una medida.
Para el debate posterior sobre la gráfica volumen (cm3) frenta al tiempo (min):
- ¿Puede la curva cortar ascender ilimitadamente? Eso implicaría un tiempo de reacción infinito, que es imposible
por agotamiento de los reactivos. La curva tenderá a la horizontal asintótica con un valor máximo teórico.
 Montaje inicial. |
|
 Introducción del tubo acodado. |
 Sistema en funcionamiento. |
 Bureta de gases. |
 Bureta de gases. |
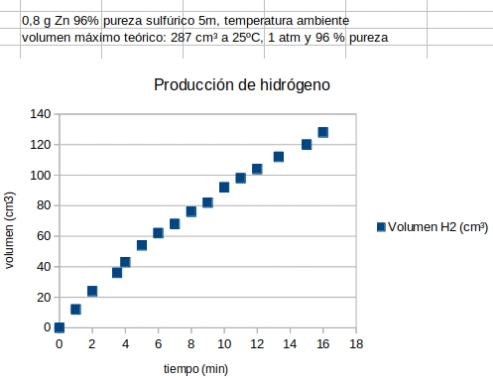 Ejemplo de resultado experimental. |
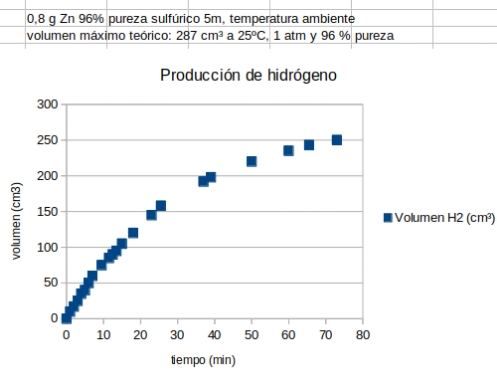 Ejemplo de resultado experimental. |

